Introducción:
Es un tema de debate al que se debe dar énfasis hoy en día por tres motivos básicos la pre valencia en países tercermundistas, los mitos asociados a la enfermedad por la población (e incluso ciertos médicos veterinarios y médicos humanos) y por la discrepancias en la vía de contagio hacia el ser humano. Este artículo es una recolección de varias fuentes sobre el tema con el fin de brindar un mejor panorama sobre esta zoonosis.

Ahora bien, antes de continuar tenemos que definir a la toxoplasmosis como una enfermedad ocasionada por un protozoario intracelular obligatorio, que quiere decir esto, que necesita de una célula para poder realizar su ciclo vital, el toxoplasma gondii tambíen tiene fases evolutivas, similar a las fases de otros protozoarios, y como todo parásito necesita de hospederos tanto definitivos como intermediarios, partiendo de estos aspectos básicos se puede estudiar la biología del parásito para comprender en que momento el ser humano se encuentra en riesgo.
Siguiendo con el estudio resolveremos estos puntos claves:
El gato y otros felinos silvestres


¿Quienes son los hospederos intermediarios?
Mamíferos entre ellos el humano, y las aves


¿Cómo se puede adquirir el toxoplasma?
En los animales:
Por consumo de carne contaminada con quistes o consumo de ooquistes esporulados a travéz de alimentos o agua contaminada
En el humano:
Por vía enteral:
- Alimentaria: por consumo de carne mal cocida y contaminada con quistes, fruta o verduras contaminadas con ooquistes, o agua contaminada. Se ha evidenciado que el Toxoplasma permanece viable en el agua luego del tratamiento con diversos medios físicos y químicos, entre ellos: el hipoclorito de sodio y el ozono, dejando abierta la posibilidad que, el agua de las ciudades sea un medio eficaz para la transmisión de la enfermedad. Sólo la radiación UV podría ser un método eficaz para la desinfección del agua.
- Accidental: Por contacto directo con heces de gatos y mala higiene.
- Transmisión mecánica: los moluscos marinos pueden actuar como vectores mecánicos, al filtrar agua contaminada pudiendo concentrar los ooquistes y así, infectar a quien los consume, ciertos autores consideran que el consumo de ostras pueden ser un factor de riesgo para mujeres embarazadas. Existen estudios epidemiológicos que proponen a los de artrópodos como vectores mecánicos del parásito, hay evidencia de transmisión mecánica por cucarachas como Periplaneta americana de igual manera las moscas sinantrópicas por la proximidad con el ser humano también son excelentes vectores mecánicos.
Por vía parenteral: se ha demostrado que de forma experimental que existe una transmisión a través de mucosa respiratoria, mucosa conjuntival, vía sanguínea, y transplante de tejidos. De manera vertical, la infección en un bebé en desarrollo sólo sucede cuando la madre tiene una primoinfección durante el embarazo. Si se obtuvo toxoplasmosis en el pasado, generalmente uno está inmune y el feto no corre riesgo, sin embargo si la madre se contagia de SIDA es muy probable que la toxoplasmosis se agudice y le transmita al feto durante el embarazo.
Ciclo del protozoario:
En el gato y otros carnívoros el contagio más común es a través de los quistes con bradizoitos o quistes tisulares, por consumo de carne mal cocida, sin embargo también se puede dar por consumo de alimentos o agua contaminada con ooquistes.
La presente lista describe las formas evolutivas del toxoplasma:Quiste: contiene bradizoitos
Pseudoquiste: contiene taquizoitos
Ooquiste: forma resistente al medio ambiente.
Esquizogonia o merogonia: etapa de multiplicación acelerada
Ezquizonte: célula progenitora que produce merozoitos
Merozoito: células hijas del esquizonte
Bradizoito: zoitos de multiplicación y metabolismo lento
Taquizoito: zoitos de multiplicación y metabolismo acelerado (forma activa)
Esporozoito: zoito formado de la esporulación de un ooquiste (forma infectiva mas común)
Trofozoito: se forma una vez que el quiste con bradizoitos se rompe tiene forma ameboide y penetra el epitelio para la formación del esquizonte
Ciclos:
Enteroepitelial

Tisular
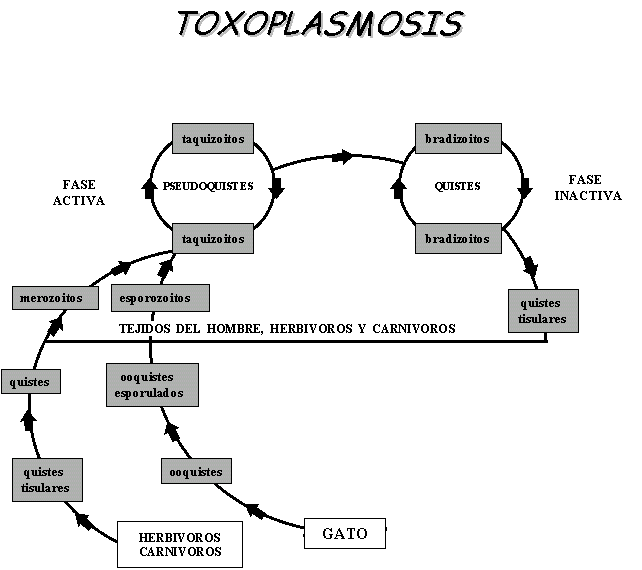
- Si el contagio fue por consumo de taquizoitos o esporozoitos (ooquiste esporulado) el periodo prepatente se extiende hasta 20 a 40 días.
- Taquizoito puede infectar las células y luego formar un pseudoquiste hasta el estallido celular e infección de nuevas células.
- žEl pseudoquiste puede evolucionar a quiste (bradizoítos).
- žLa esporulación del ooquiste en el medio ambiente se da entre 1 a 5 días.
- Cada quiste esporulado forma dos esporoquistes y cada uno desarrolla 4 esporozoítos.
- El gato solo elimina los ooquistes entre 15 a 20 días.
Manifestaciones clínicas en humanos:
Depende mucho del sistema inmune del individuo, por lo general cursa de manera asintomática y crónica en la mayoría de los casos, en algunos casos de manera aguda con una ligera sintomatología no específica, y en menor grado cursa con una sintomatología que compromete múltiples órganos e implica un riesgo de mortalidad elevada. Para esto previamente definiremos la población en riesgo que tiene mayor probabilidad de adquirir toxoplasmosis en su forma mas agresiva, dentro de ellos se encuentran: los niños, las personas de la tercera edad, pacientes inmunosuprimidos como los pacientes con SIDA o que han recibido una terapia con corticoides de manera prolongada y las madres gestantes. Continuando con la descripición de las manifestaciones clínicas, se ha clasificado tomando como fuente bibliográfica el libro de Parasitosis humanas y el libro de Parasitologia medica:
Toxoplasmosis adquirida en pacientes inmunocompetentes: las siguientes formas descritas son mas frecuentes en niños, muy rara vez se presentan en adultos con un sistema inmunitario sano, sin embargo puede presentarse en casos excepcionales un cuadro agudo fulminante generalizado, las formas de toxoplasmosis adquirida pueden ser:
- Forma aguda: aparece bruscamente con un cuadro febril inespecífico, con fiebre alta, escalofríos, sudoración, cefalea astenia y anorexia.
- Forma linfadenopática o ganglionar: es de mayor incidencia en niños y adultos jóvenes, muy similar a la forma aguda sumado a poliadenopatías, también se asocia a una faringitis granulomatosa.
- Forma ocular: se presenta en casos muy excepcionales durante una infección aguda, la mayoría de casos ocurre por una reactivación de una toxoplasmosis congénita por lo general en la adolescencia.
Se han descrito la forma pulmonar, miocárdica, hepática y cefálica en pacientes inmunocompetentes en casos muy excepcionales, esto puede ocurrir a pesar de que haya existido previamente una diseminación que transcurrió de forma subclínica o clínicamente no reconocida.
Toxoplasmosis en el inmunosuprimido: puede ocurrir de manera multisistémica, pudiendose presentar la forma pulmonar, miocárdica, hepática, o cefálica . En pacientes con SIDA la complicación más común ocurre en el sistema nervioso, presentando pérdida de la sensibilidad, hemiplejía, hemiparesia, convulsiones, afasia, ataxia, confusión, letargia.
Toxoplasmosis congénita: ocurre como mencioné anteriormente si la madre se infecta por primera vez en su vida durante la gestación, si la madre se infecta antes de la gestación el niño no desarrolla una infección. El riesgo de transmisión congénita es del 65% en fetos que cursan el último tercio de gestación, la explicación más lógica de este alto porcentaje, es quizá, porque en el último tercio de gestación el feto presenta mayor desarrollo de tejidos y sabemos que el toxoplasma es un protozoario intracelular obligatorio, esto implica mayor ventaja para su replicación, además del debilitamiento de la barrera transplacentaria relacionado al tiempo de gestación, todo esto obviamente se asocia a la inmunidad materna y al número de microorganismos. La cifra baja 25% a 17%, cuando la infección ocurre en el segundo y primer tercio de gestación. Otro dato importante es que el 70% de nacidos son asintomáticos, el 20% presenta una forma aguda generalizada o secuelas neurológicas, y el 10% presentan compromiso ocular solamente. Con estas premisas se concluye que el mayor riesgo de contagio ocurre en el último tercio de gestación sin embargo las secuelas irreversibles que es la que mayormente se describe en la cultura urbana se presentan en el primer y segundo tercio de gestación. Ojo cabe la posibilidad también de que una madre portadora de SIDA sea a la vez portadora de toxoplasma y esta última se reactive durante el embarazo. Con respecto a los cuadros abortivos relacionados con la toxoplasmosis, existen mucho temor y dudas por parte de la población; revisando alguna literatura, resumo, que el aborto se presenta por lo general cuando la infección se presenta en los primeros meses de gestación, y que hay algunas discrepancias entre investigadores sobre el aborto espontáneo se necesita investigar mas sobre las condiciones para que se presente este cuadro.
Recalco que la descripción anterior sobre la manifestación en humanos la hice de manera breve debido a que es estudio de mayor profundidad para la medicina humana y el objetivo de este artículo es solo de actualidad veterinaria con respecto a esta zoonosis.
Manifestaciones clínicas en animales:
Gatos: se ha demostrado que experimentalmente puede producir enteritis, y cambios degenerativos en el sistema nervioso. Normalmente la infección es asintomática en situación real, la probabilidad de que desarrolle síntomas es mínima.
Perros: por lo general asintomática, esta asociado a co-infección con enfermedad de moquillo canino es poco probable el desarrollo de síntomas.
Rumiantes: por lo general asintomática ocurre con la misma sintomatología y la importancia radica en los abortos en ovejas y mortalidad perinatal de las crías, por infección transplacentaria, si la infección es en etapa temprana de gestación (<55días) o a la mitad ocurre muerte y expulsión de fetos momificados y reducidos y si es en la etapa final, nacen corderos débiles.
Gatos: se ha demostrado que experimentalmente puede producir enteritis, y cambios degenerativos en el sistema nervioso. Normalmente la infección es asintomática en situación real, la probabilidad de que desarrolle síntomas es mínima.
Perros: por lo general asintomática, esta asociado a co-infección con enfermedad de moquillo canino es poco probable el desarrollo de síntomas.
Rumiantes: por lo general asintomática ocurre con la misma sintomatología y la importancia radica en los abortos en ovejas y mortalidad perinatal de las crías, por infección transplacentaria, si la infección es en etapa temprana de gestación (<55días) o a la mitad ocurre muerte y expulsión de fetos momificados y reducidos y si es en la etapa final, nacen corderos débiles.
Medidas preventivas:
Investigaciones:
Bibliografía:
- Es preciso cocer totalmente la carne.
- A los gatos se les darán alimentos secos, enlatados o hervidos y no se les permitirá que cacen no que coman desperdicios de los basureros.
- Las heces del gato y el material donde las deposita deben desecharse todos los días (antes de que los esporozoitos se vuelvan infectantes). Las heces se pueden echar al retrete, quemar o enterrar a gran profundidad. Las cajas que contienen la arena u otro material donde depositan las heces deben desinfectarse diariamente, escaldándolas con agua hirviendo; y cuando manipule algún material que pueda estar infectado se utilizará guantes.
- Las madres embarazadas no deben ocuparse de limpiar las cajas en que el gato deposita las heces ni tampoco estar en contacto con el animal si se desconoce lo que ha comido o tiene hábitos de cazar. Tampoco deben trabajar en el jardín o por lo menos deben llevar guantes y lavarse bien las manos cuando termine esas tareas.
- Pese a que no se ha encontrado reportes que demuestren la presencia de ooquistes esporulados en el pelo del gato, debemos tener en cuenta que el hábito del felino es lamerse frecuentemente el cuerpo, y probablemente este factor predisponga que el felino contamine su pelaje después de lamerse la zona perineal. Sin embargo deben darse muchos factores para que el ooquiste permanezca viable en el pelo del gato (carga microbiana, temperatura, humedad, muda, periodo de eliminación de ooquistes, tiempo de esporulación, baño del animal, además de la barrera de defensa que es la producción de moco y la reacción de hipersensibilidad que esta provoca resulta a las finales en la eliminación del pelo de la cavidad nasal.), además de eso, los ooquistes deben pasar de la cavidad nasal hacia la nasofaringe para después ser ingerido, lo cual supone un riesgo mínimo o casi nulo para la salud pública, aún así se recomienda cierto cuidado con el contacto del animal en madres gestantes sobre todo ya que se ha demostrado el contagio por vías respiratorias de manera experimental en animales.
- Existe un reporte de infección por vía inhalatoria, en un establo en Giorgia - Atlanta sin embargo dicho reporte tiene poco fundamento como para asociarlo a esta vía, quedan algunas dudas sobre esta alternativa de transmisión, ya que las formas infectantes deberían ser los ooquistes, los cuales pudieron haber sido aerosolizados y posteriormente, ingeridos para la generación de la enfermedad; no obstante, para que este proceso ocurra, es necesario que haya desecación que permita la aerosolización, asociada a la exposición a la luz solar, dos factores que pueden ser deletéreos para la viabilidad de los ooquistes.
- Las investigaciones han demostrado que la mayor vía de contagio es a través de carne mal cocida.
Investigaciones:
Seroprevalencia
en animales y humanos:
(Solorio
y otros, 2010)
El estudio
se enfocó a determinar la prevalencia de toxoplasma pecaríes, se analizó los
sueros de 101 pecaríes de labios blancos en la amazonía obtenidos de 3 áreas de
conservación diferentes ubicadas en los municipios de Manu y Tambopata.
Los
anticuerpos se analizaron utilizando la prueba de aglutinación indirecta para
Toxoplasma gondii
Se
encontraron en 89,1% (90 de 101) de los animales, con títulos de 1: 25 en 9, 1:
50 en 25, 1: 100 en 20, 1: 200 en 14, 1: 400 en 12, 1: 800 en 9 y 1: 3200 en 1.
(Suárez
y otros, 2000)
La
prevalencia de esta infección se estimó en 396 sueros de cerdos de 5 meses
obtenidos en los mataderos, en São Paulo, Brasil (300) y Lima, Perú (96). Se
encontró que la seroprevalencia fue mayor en los cerdos de Perú (32,3%) en
comparación con Brasil (9,6%), tal como se detecta por ELISA y Western Blot.
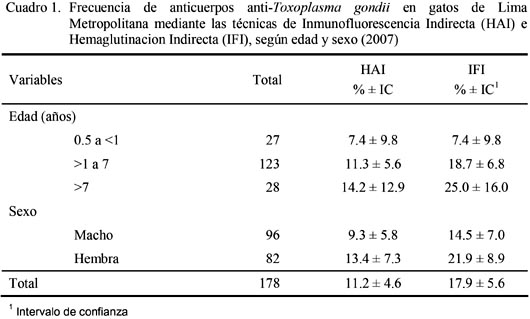
(Cerro
y otros, 2009)

Se demostró
la frecuencia de anticuerpos anti toxoplasma presentes en el suero de felinos,
mediante la prueba de hemaglutinación indirecta e inmunofluorescencia
indirecta, encontrando el siguiente
resultado.
La
clasificación de la fase clínica de la enfermedad mediante la titulación de los
sueros a través de HAI y la identificación de IgM con el empleo de
2-mercaptoetanol mostró que el 60% de los animales seropositivos presentaban
solo IgG; es decir, que se tratarían de casos crónicos en base a infecciones
antiguas. Por otro lado, el 40% de los gatos seropositivos se encontraban en la
fase aguda; hecho demostrado al usar 2-ME y observar la disminución de los títulos
de al menos dos diluciones comparados con los mismos sueros sin tratar con 2-ME.
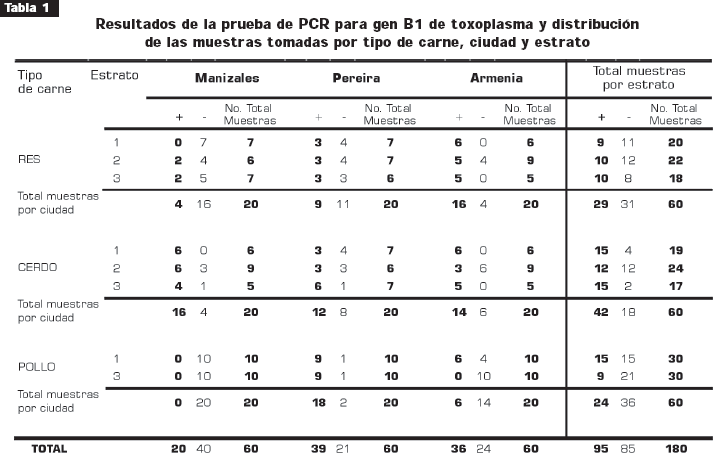
(Lora y otros, 2007)
Mediante la técnica de PCR se llegó a reconocer la presencia de toxoplasma en muestras de carne. Se tomaron 20 muestras para cada tipo de carne (res, cerdo y pollo), en tres ciudades diferentes de Colombia y se clasificó según estratos. El estrato 1, establecimientos comerciales que no cuentan con cadena de frío, ni lugares adecuados de almacenamiento y con condiciones mínimas de higiene; estrato 2, establecimientos comerciales que cuentan con nevera para refrigeración y conservación de la carne, y estrato 3, establecimientos comerciales con cuartos de congelación.

El cuadro demuestra la mayor prevalencia de toxoplasma en la carne de cerdo implicando un mayor riesgo en el contagio por por consumo de carne.
(Saavedra
y Ortega, 2004)
En dicho
estudio se determinó por western blot, la prevalencia de Ig G de T. gondii en
cerdos de Perú y Estados Unidos.
Las
muestras de sangre fueron recolectadas de 137 cerdos en un matadero en Lima,
Perú, y 152 cerdos en un matadero de Georgia.
De las
muestras de suero recogidas de cerdos, el 27,7% (n = 38) de Perú y 16,4% (n =
25) de los Estados Unidos fueron positivos para T. gondii.
(Sakikawa y otros, 2012)
Se midió los títulos de anticuerpos anti toxoplasma, mediante prueba de aglutinación en 4466 mujeres embarazadas durante un periodo de 7.5 años en Japón.
La prevalencia global de anticuerpos anti toxoplasma fue de 10,3% y fue significativamente mayor en mujeres por encima de los 35 años.
La tasa de primo infección por toxoplasma durante el embarazo se estimó en 0,25%.
Se determinó como factor de riesgo una historia de consumo de carne en base a encuestas a las mujeres positivas.
En resumen a lo ya expuesto debemos tener claro como médicos veterinarios que:
- Es el gato y la familia de felinos a través de sus heces, son los únicos que pueden diseminar el toxoplasma en el ambiente, no es el perro, el ave u otro animal.
- El gato solo disemina al ambiente y la única forma que el humano pueda contagiarse es a través del contacto con heces de felino y por mala higiene.
- Aunque suene raro el consumo de carne de gato mal cocida podría implicar también un riesgo, en Perú existe esta costumbre en el sur.
- El consumo de carne mal cocida es la principal vía de contagio de este parásito, no es la creencia popular del pelo del gato.
- Se ha demostrado de manera experimental el contagio por inoculación en mucosa respiratoria, esto implica un riesgo mínimo para la persona, los motivos ya lo expusimos anteriormente y resultan ser obvios.
- Es la vía enteral a través de alimentos la vía de mayor contagio, y esto no abarca solo carne puede ser fruta, verduras y agua contaminada.
- El gato solo elimina al ambiente los ooquistes aproximadamente por unos 15 a 20 días, después de esto nunca mas vuelve a eliminar.
- No existe contagio de humano a humano salvo por la vía trasplacentaria
- Tras revisar las investigaciones se puede concluir que es la carne de cerdo seguida de la de res las que implican mayor riesgo para un contagio por alimentos.
- Las madres solo pueden transmitirle al feto si se presenta una primoinfección durante el embarazo.
- BOTERO D. y RESTREPO M. (2003). Parasitosis humanas, 4° edic. Colombia- Medellín, CIB edit., pp. 262 - 279.
- ATIAS A. (1998). Parasitología médica 1° edic.
- BOWMAN D. , LYNN R. y EBERHARD M. (2004). Parasitología para veterinarios, 8° edic. España -Madrid, Elseiver edit. pp. 105 -107.
- URQUHART G. y OTROS. (2001). Parasitología veterinaria, 2° edic. España - Zaragosa, edit. Acribia pp. 267 -271.
- SOLORIO M. y OTROS. (2010).Toxoplasma gondii antibodies in wild white-lipped peccary (Tayassu pecari) from Peru J Parasitol 96(6):1232. http://www.ncbi.nlm.nih.gov/pubmed/21158643
- SUAREZ A. y OTROS. (2000).The prevalence and avidity of Toxoplasma gondii IgG antibodies in pigs from Brazil and Peru. Vet Parasitol 91(1-2):23-32. http://www.ncbi.nlm.nih.gov/pubmed/10889357
- CERRO L. y OTROS. (2009). Frecuencia de Toxoplasma gondii en gatos de Lima Metropolitana y concordancia entre las técnicas de inmunofluorescencia indirecta y hemaglutinación indirecta. Rev. investig. vet. Perú v.20 n.2. http://www.scielo.org.pe/scielo.php?pid=S160991172009000200020&script=sci_arttext
- LORA F. y OTROS. (2007). Detección de Toxoplasma gondii en carnes de consumo humano por la técnica de reacción en cadena de la polimerasa en tres ciudades del eje cafetero. Infect. vol.11 no.3. http://www.scielo.org.co/scielo.php?pid=S0123-93922007000300004&script=sci_arttext
- SAAVEDRA G. y ORTEGA Y. (2004). Seroprevalence of Toxoplasma gondii in swine from slaughterhouses in Lima, Peru, and Georgia, U.S.A. J Parasitol. 90(4):902-4. http://www.ncbi.nlm.nih.gov/pubmed/15357100
- SAKIKAWA M. (2012). Anti-Toxoplasma antibody prevalence, primary infection rate, and risk factors in a study of toxoplasmosis in 4,466 pregnant women in Japan. Clin Vaccine Immunol 19(3):365-7. http://www.ncbi.nlm.nih.gov/pubmed/2220565
- PÉREZ J. y OTROS. (2001). Formas alternas de transmisión de Toxoplasma gondii. Biosalud vol.10 no.2. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S1657-95502011000200012
